Hmotnosť:
3108.32 g/mol
- Vzorec:
C129H215N33O55
- Sekvencia:
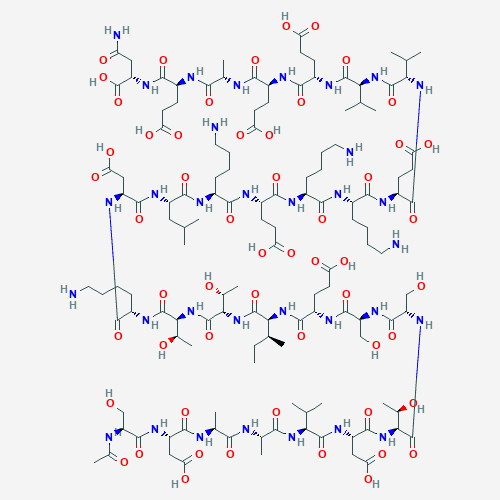
Ac-Ser-Asp-Ala-Ala-Val-Asp-Thr-Ser-Ser-Glu-Ile-Thr-Thr-Lys-Asp-Leu-Lys-Glu-Lys-Lys-Glu-Val-Val-Glu-Glu-Ala-Glu-Asn-OH
- CAS:
62304-98-7
INFORMÁCIE O PEPTIDE
Thymosin alpha 1 (Tymozín alfa 1) je peptid, ktorý sa prirodzene nachádza v týmuse, a o ktorom je už dlhšie známe, že modifikuje, zvyšuje a obnovuje imunitné funkcie. Thymosin alpha 1 sa používa pri liečbe stavov so zníženou imunitou a malignít, ako posilňovač odpovede na vakcínu a ako prostriedok na potlačenie chorobnosti a úmrtnosti na sepsu a početné infekcie. Štúdie predpokladajú, že thymosin alpha 1 by mohol pomôcť zlepšiť výsledok u ťažko chorých pacientov na koronavírusové ochorenie 2019, a to liečením poškodení spôsobených nadmernou aktiváciou lymfocytovej imunity, a taktiež ako thymosin alpha 1 môže zabrániť nadmernej aktivácii T buniek. V tomto posudku rozoberáme kľúčovú literatúru o základných znalostiach a súčasnom klinickom použití produktu thymosin alpha 1. Vzhľadom na známe biochemické vlastnosti vrátane antibakteriálnych a antivírusových vlastností, časovo overených aplikácií a nových sľubných zistení týkajúcich sa po- užitia produktu thymosin si myslíme, že thymosin alpha 1 si zaslúži ďalšie preskúmanie jeho antivírusových vlastností a možného opätovného nasadenia ako liečby proti ťažkému akútnemu respiračnému syndrómu koronavírus-2.
Thymosin alpha 1 je peptid s 28 aminokyselinami, ktorý bol pôvodne izolovaný z týmusu [1], a ktorý bol v značnej miere skúmaný z hľadiska jeho funkcií v imunitnom systéme. Thymosin alpha 1 je už dlhšie uznávaný ako látka posilňujúca imunitu, modulujúca imunitu, aj ako prostriedok na obnovenie imunity [2], a ako taký sa využíva v početných klinických a výskumných zariadeniach. Syntetická forma prostriedku thymosin alpha 1, tymalfasín, je schválená vo viac ako 35 krajinách na liečbu hepatitídy B a C a ako posilňovač imunity pri niekoľkých ďalších ochoreniach [1]. Presnejšie, je prínosom ako prostriedok na zvýšenie imunitnej odpovede pri imunitnej nedostatočnosti [3], pri psoriatickej artritíde[4], pri starnutí[3], ako aj pri zvyšovaní odpovede na vakcíny[3] a znižovaní toxicity vyvolanej chemoterapiou[5]. Ďalej má veľký význam pri liečbe onkologických pacientov, najmä pacientov s hepatocelulárnym karcinómom, karcinómom renálnych buniek a nemalobunkovým karcinómom pľúc [5]. V neposlednom rade sa používa v boji proti mnohým infekciám, ako je vírus ľudskej imunodeficiencie (HIV) [6], pseudomonas[1], a plesňovej toxicite[7], ako aj sepse[8], a nedávno pri ťažko chorých pacientoch na koronavírusové ochorenie 2019 (COVID-19)[9]. Vzhľadom na súčasnú pandemickú situáciu sa na celom svete vyvíja úsilie na pochopenie vplyvu infekcie spôsobenej ťažkým akútnym respiračným syndrómom koronavírus-2 (SARS-CoV-2) na imunitný systém v nádeji, že sa priblížia k účinnej liečbe. S týmto účelom by bolo vhodné ďalej skúmať thymosin alpha 1 prostredníctvom príslušnej publikovanej literatúry. V tomto posudku sa zameriavame na pochopenie charakteristík produktu thymosin alpha 1, od jeho chemickej štruktúry a biologických vlastností až po jeho klinické aplikácie, ich bezpečnosti a účinnosti, ktoré by poskytli prehľad o tom, či by sa dal použiť ako terapeutická možnosť na obmedzenie úmrtnosti a zlepšenie výsledkov u ťažko chorých pacientov s COVID-19.
HLAVNÉ ÚČINKY PEPTIDU
Thymosin alpha 1 funguje ako mýtny receptor (TLR) -9 a agonista TLR-2 v myeloidných aj dendritových bunkách, v profesionálnych bunkách prezentujúcich antigén.[20]. Zacielením na TLR môže thymosin alpha 1 stimulovať adaptívnu imunitnú odpoveď, ktorá je nevyhnutná na boj proti vírusovým, bakteriálnym a plesňovým infekciám a rakovinám, ako aj stimuláciu posteriórnej humorálnej imunity[20-22]. Thymosin alpha 1 môže ďalej zvyšovať hladiny IL-2, IL-10, IL-12, interferónu (IFN) -α a IFN-y[23]. Úloha látky thymosin alpha 1 pri stimulácii produkcie protilátok závislých od T-buniek je tiež dôvodom, prečo sa považoval za adjuvans vakcíny na zvýšenie odpovede na vakcíny.[24].
Thymosin alpha 1 má širokú škálu biologických aktivít, ktoré sa pohybujú od protinádorových až po imunomodulačné vlastnosti (Obrázok (Obrázok č. 1).1). Imunitná odpoveď látky thymosin alpha 1 je spôsobená jeho pôsobením pri zvyšovaní aktivity dozrievania T buniek na CD4+/CD8+ T buniek. Funguje na princípe priamej aktivácie prirodzených ničiacich buniek, ako aj CD8+ T buniek, prostredníctvom ktorých ničí vírusovo infikované bunky. Thymosin alpha 1 má negatívny účinok na IL-1β a α-faktor nekrózy nádorov, čo vedie k zníženiu zápalovej odpovede a je dosť prospešný pri ochoreniach, ako je chronická hepatitída a akútna pankreatitída. Nielenže zohráva úlohu pri zvyšovaní expresie cytokínov, ale tiež zvyšuje dôležitosť hlavného komplexu histokompatibility l/vírusových antigénov na ich príslušných cieľových infikovaných bunkách a znižuje replikáciu vírusu[6]. Naylor a jeho spolupracovníci zdôraznili, že thymosin alpha 1 nemá iba jeden, ale má aj rôznorodú škálu cieľov pre svoju imunitu zvyšujúcu aktivitu[25].
Thymosin alpha 1 vykazuje schopnosť brániť rastu nádorov, a preto sa používa pri liečbe rôznych druhov rakoviny. Má antiproliferatívne vlastnosti, ktoré sa prejavili v metastázach nádorov pľúc a pečene. Podľa štúdií vykonaných Moodym et al[25], proti nádorová aktivita látky thymosin alpha 1 fungovala najlepšie pri malej veľkosti nádoru. Vo všeobecnosti látka thymosin alpha 1 funguje via dva hlavné mechanizmy: Buď stimuluje imunitný systém, alebo využíva svoje antiproliferačné aktivity na nádorových bunkách. Ochranné pôsobenie látky thymosin alpha 1 proti oxidačnému poškodeniu v dôsledku jeho účinku na superoxid dismutázu pečene a glutatiónperoxidázu preskúmal Armutcu et al[26].
Pretože thymosin alpha 1 je polypeptid prirodzene sa nachádzajúci v týmuse, zohráva zásadnú úlohu pri kontrole zápalu, imunity a tolerancie. Thymosin alpha 1 má imunomodulačný účinok prostredníctvom svojej interakcie s mýtnymi receptormi. Kvôli pôsobeniu látky thymosin alpha 1 na iné bunkové typy používa sa ako terapeutický prostriedok pri ochoreniach so zjavnou imunitnou dysfunkciou[4]. Klinické testy s látkou thymosin alpha 1 boli vykonané na ochorenia ako DiGeorgeov syndróm, nemalobunkový karcinóm pľúc, hepatocelulárny karcinóm, hepatitída B a C, HIV a melanóm, a priniesli sľubné výsledky[27,28]. FDA schválila liek na zriedkavé choroby thymalfasin (Zadaxin) na liečbu malígneho melanómu, chronickej aktívnej hepatitídy B, DiGeorgeovej anomálie s imunitnými defektmi a hepatocelulárneho karcinómu, a to kvôli jeho imunomodulačnému a protinádorovému účinku.
KLINICKÉ A KOMERČNÉ APLIKÁCIE
Thymosin alpha 1 je rozsiahlo testovaný a jeho syntetická forma, thymalfasin, je vo veľkej miere používaná v klinickej oblasti (Obrázok (Obrázok č. 2).2). Niektoré z jeho aplikácií sú nasledovné.
epatitída B
Bezpečnosť a účinnosť látky thymosin alpha 1 u pacientov s chronickou hepatitídou B boli testované prostredníctvom klinických štúdií. Thymosin alpha 1 je testovaný ako monoterapia, ako aj v kombinácii s interferónom-alfa a inými nukleozidovými analógmi. Zistila sa miera úplnej virologickej odpovede [klírens deoxyribonukleovej kyseliny vírusu hepatitídy B a antigénu hepatitídy B] 40,6 % u pacientov, ktorí dostávali 1,6 mg subkutánnej injekcie dvakrát týždenne, a 26,5 % u pacientov, ktorí dostávali rovnaký režim počas 52 týždňov[29]. Je však dôležité poznamenať, že liečba hepatitídy B pomocou látky thymosin alpha 1 sa používala iba v ére interferónu a v súčasnosti je zastaraná v ére po objavení priamych antivírusových látok.
Hepatitída C
Zdá sa, že thymosin alpha 1 ako monoterapia nie je pri liečbe infekcie hepatitídou C užitočný.
Avšak kombinovaná liečba látkou thymosin alpha 1 a pegylovaného interferónu alfa 2a by mohla účinne potlačiť vírusovú replikáciu u pacientov s hepatitídou C. Thymosin alpha 1 v kombinácii s interferónom alfa 1 bol tiež testovaný na liečbu u pacientov s chronickou hepatitídou C. Okrem toho je thymosin alpha 1 dobre tolerovaný bez významných nežiaducich účinkov. Metaanalýza uskutočnená Shermanom zahŕňala mnoho štúdií ukazujúcich prevahu kombinácie tymozínu alfa 1 a interferónu alfa 1 v porovnaní s monoterapiou interferónom alfa[30]. Je stále potrebné poznamenať, že podobne ako pri hepatitíde B, bola liečba hepatitídy C s látkou thymosin alpha 1 prerušená v prospech priamych antivírusových látok.
Sepsa
Použitie látky thymosin alpha 1 u pacientov so sepsou preukázalo významné zníženie úmrtnosti v dôsledku zlyhania viacerých orgánov, ktoré je hlavnou príčinou smrti pri sepse[8].
Infekcia HIV
Kombinovaná liečba látkou thymosin alpha 1, interferónom alfa 1 a zidovudínom bola u pacientov s HIV dobre tolerovaná. Thymosin alpha 1 zvyšuje funkciu a zvyšuje počet CD4+ T buniek, a zároveň znižuje vírusovú záťaž. Thymosin alpha 1 ovplyvňuje produkciu týmusových T-buniek. Bezpečnosť a účinnosť látky thymosin alpha 1 v kombinácii s vysoko aktívnou antiretrovírusovou terapiou pri stimulácii imunitnej rekonštitúcie sa potvrdila[6]. Ukázalo sa, že thymosin alpha 1 je dobre tolerovaný a mohol by dramaticky zvýšiť hladinu excíznych kruhov signálneho kĺbového receptoru T buniek u pacientov s pokročilým ochorením HIV. Účinnejšie je dlhodobé užívanie vysokých dávok látky thymosin alpha 1[2].
Pseudomonas – pacienti po transplantácii kostnej drene
Thymosin alpha 1 sa používa aj pri iných infekciách, ako sú pseudomonády alebo infekcie po transplantácii kostnej drene[1].
Plesňová toxicita
Tento týmusový peptid má schopnosť primárne aktivovať dendritové bunky a zosilňovať Th1 a Treg bunky tak, aby bol zápal vyrovnaný a bola vyvinutá antifungálna odpoveď. Odpoveď Th1 aktivuje produkciu Th2 cytokínov (IFN-y, IL-2, IL-12, IL-18), stimuluje fagocytárnu aktivitu. Preto sa budú produkovať cytotoxické CD4+, CD8+ a T bunky a opsonizujúce protilátky, ktoré budú generovať ochranný účinok proti plesňovým patogénom[7].
Imunitná nedostatočnosť
Liečba látkou thymosin alpha 1 slúži ako stimul pre expresiu receptora IL-2 a internalizáciu IL-2. Má tiež uzdravujúci účinok na pacientov s potlačenou aktivitou ničiacich buniek aktivovaných lymfokínmi a s imunodeficienciou[29]. Thymosin alpha 1 účinkuje prostredníctvom Mýtnych receptorov v myeloidných aj plazmacytoidných dendritových bunkách a stimuluje signálne dráhy a iniciuje produkciu imunitných cytokínov. Očakáva sa teda, že thymosin alpha 1 prinesie povzbudivé výsledky v liečbe pacientov so zníženou imunitou. Celkovo zlepšuje funkciu imunitného systému bez toho, aby spôsoboval nežiaduce výsledky[13].
Psoriatická artritída
Thymosin alpha 1 je silný modulátor imunity a zápalu. Pribúdajú dôkazy, že choroby charakterizované dereguláciou imunitného systému a zápaly, ako je psoriatická artritída, sú spojené so sérovými hladinami látky thymosin alpha 1 významne nižšími ako u zdravých jedincov. Údaje zodpovedajú úlohe látky thymosin alpha 1 ako regulátora imunity, tolerancie a zápalu u pacientov so psoriatickou artritídou[4].
Očkovacie adjuvans
Použitie látky thymosin alpha 1 ako adjuvans k chrípkovej vakcíne ukázalo sľubné výsledky, najmä u starších pacientov a pacientov s oslabenou imunitou[31]. Ukázalo sa tiež, že thymosin alpha 1 zlepšuje imunogenicitu chrípkovej vakcíny[3].
Zníženie toxicity z chemoterapie
Klinické štúdie ukazujú, že thymosin alpha 1 sa používa u pacientov s rôznymi malignitami, čo znižovalo toxicitu chemoterapie a zlepšovalo kvalitu života. Zvýšenie počtu a funkcií imunitných buniek a zníženie toxicity z chemoterapie bolo tiež účinkom používania tohto lieku. Spravidla sa počas chemoterapie vyskytlo menej infekcií, znížila sa neurotoxicita a zlepšila sa kvalita života[5].
Oxidačné poškodenie, lézie pankreasu a cukrovka
Mnoho štúdií preukázalo, že thymosin alpha 1 má ochranné účinky pred oxidačným poškodením. Thymosin alpha 1 významným posilnením aktivity katalázy, superoxiddismutázy a glutatiónperoxidázy znižuje produkciu reaktívnych foriem kyslíka a zabraňuje oxidačnému poškodeniu pečeňového tkaniva. Thymosin alpha 1 má dobre zavedené antiproliferatívne vlastnosti pozorované pri rôznych malignitách u ľudí, čo je výsledkom jeho schopnosti znižovať oxidačný stres[6]. Pomáha tiež zmierniť poškodenie pankreasu a dôsledky cukrovky znížením produkcie malondialdehydu a zlepšením funkcie superoxiddismutázy a katalázy. Antioxidačné vlastnosti látky thymosin alpha 1 sa považujú za veľmi osožné pri liečbe pankreatických lézií[32].
Aplikácie u onkologických pacientov
Viaceré štúdie preukázali sľubné výsledky pri použití látky thymosin alpha 1 u pacientov s metastatickým melanómom, karcinómom hlavy a krku, s rakovinou pľúc, rakovinou prsníka a hepatocelulárnym karcinómom[33]. Thymosin alpha 1 je indikovaný ako adjuvans na chemoterapiou vyvolanú imunitnú depresiu, imunitnú nedostatočnosť a imunitnú supresiu u pacientov[5]. Okrem toho sa ukázalo, že thymosin alpha 1 v kombinácii s chemoterapiou alebo ožarovaním zlepšuje mieru prežitia u pacientov s nemalobunkovým karcinómom pľúc, ktorý predstavuje 85 % všetkých druhov rakoviny pľúc a je známy svojou nízkou reakciou na chemoterapiu[5].
MOHOL BY THYMOSIN ALPHA 1 ZLEPŠIŤ VÝSLEDKY U PACIENTOV S COVID-19?
Pandémia COVID-19 má celosvetový dopad a viaceré štúdie preukázali imunologické účinky tejto choroby. Všetky krajiny postihnuté so SARS-CoV-2 sa zameriavajú na hľadanie účinnej liečby. Thymosin alpha 1 má veľmi významnú úlohu pri kontrole imunity aj pri zápaloch (Tabuľka (Tabuľka č. 2).2). Doteraz sa používal pri rôznych patologických stavoch: Infekcie, sepsa, imunodeficiencie a zhubné nádory. Zistilo sa tiež, že obmedzuje úmrtnosť u niekoľkých z nich, ako je sepsa a infekcia HIV. Aj keď klinické štúdie o účinnosti látky thymosin alpha 1 pri liečbe COVID-19 sú stále obmedzené, bolo by veľmi užitočné ďalej skúmať potenciálnu prospešnosť, ktorú tento liek môže priniesť pri zmierňovaní devastujúcich účinkov súčasnej pandémie.
Nedávna štúdia u pacientov s COVID-19 preukázala, ako thymosin alpha 1 významne podporuje proliferáciu aktivovaných T buniek, čo viedlo ku kritickej prevencii lymfopénie u infikovaných pacientov. Celkovo sa štúdie zúčastnilo 25 ťažko a kriticky chorých pacientov. Jedenásť z nich dostávalo dennú liečbu s látkou thymosin alpha 1 po dobu jedného týždňa, zatiaľ čo zvyšok pacientov nebol liečený. Údaje ukazujú, že pacienti v skupine liečenej s látkou thymosin alpha 1 mali vyšší počet lymfocytov ako pacienti bez liečby[42]. V inej retrospektívnej štúdii uskutočnenej v Číne dostávali pacienti v liečebnej skupine subkutánne injekcie 10 mg látky thymosin alpha 1 raz denne najmenej sedem po sebe nasledujúcich dní. Suplementácia s látkou thymosin alpha 1 preukázala zlepšenie a obnovenie počtu T buniek u pacientov s COVID-19 s ťažkou lymfocytopéniou a nakoniec suplementácia s látkou thymosin alpha 1 znížila úmrtnosť u ťažko chorých pacientov na COVID-19[30].
Pri liečbe COVID-19 sa predpokladá, že sa thymosin alpha 1 podáva ako intramuskulárna injekcia počas 7 dní u pacientov, ktorí majú bunky CD8 menej ako 400/μL a bunky CD4 menej ako 650/μL. Toto sa predpokladá na základe pochopenia, že indukcia látky thymosin alpha-1 preukázala zlepšenie počtu T buniek u starších pacientov s komorbiditami, ako sú hypertenzia a kardiovaskulárne ochorenia. Zdraví ľudia starší ako 60 rokov by mali dostávať thymosin alpha 1 ako doplnok na prevenciu infekcie COVID-19[43]. Tiež sa predpokladá, že thymosin alpha 1 užívaný pred podaním metylprednizolónu pacientom s COVID-19 môže zabrániť úmrtiu tymocytov vyvolanému steroidmi[44]. Čínska národná zdravotnícka komisia zahrnula thymosin alpha 1 ako alternatívnu možnosť liečby pre pacientov s lymfocytopéniou alebo imunodeficienciou.
DÁVKOVANIE A APLIKÁCIA PEPTIDU
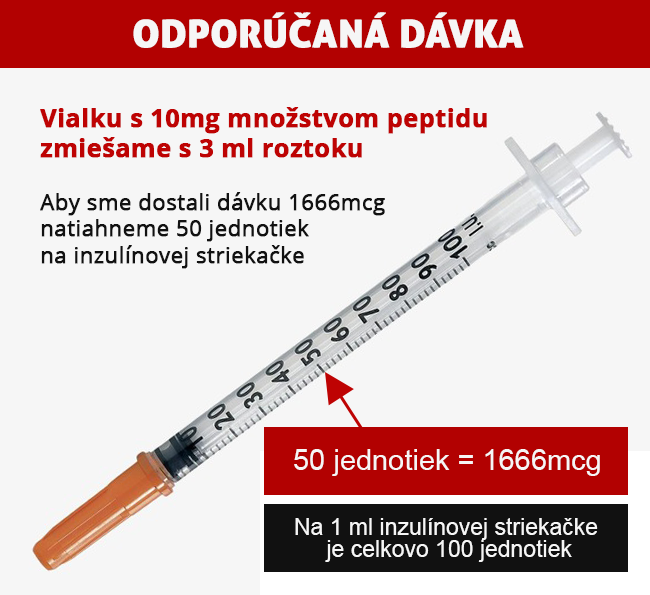
Thymosin Alpha 1 je odporúčané dávkovať 2-3 krát týždenne v množstve 1,6 mg (1600mcg) pre jednotlivú dávku. Dávka sa môže aplikovať kedykoľvek v priebehu dňa. Odporúčaná dĺžka cyklu je 7-14 dní. Peptid sa odporúča aplikovať subkutánnou injekciou (podkožná aplikácia) pomocou inzulínovej striekačky. Aplikovať sa musí nalačno (po 1-3 hodinách od posledného jedla) a po aplikáci peptidu je potrebné nepríjmať potravu aspoň ďalších 20-30 minút.
| TYP DÁVKY | MNOŽSTVO PRE DÁVKU |
| Minimálna dávka | 1666 mcg |
Vedľajšie účinky PEPTIDU
Thymosin Alpha 1, je zvyčajne dobre znášaný. Medzi najčastejšie nepriaznivé účinky patrí miestne podráždenie, začervenanie alebo nepríjemné pocity v mieste vpichu. V klinických štúdiách sa v porovnaní s interferónom-alfa 2b samotným alebo s placebom spozorovalo, že kombinácia tymalfasínu s interferónom 2b mala zriedkavé vedľajšie účinky, ako je horúčka, únava, bolesti svalov, nevoľnosť, vracanie a neutropénia[34]. Thymosin Aplha 1 je kontraindikovaný u pacientov s precitlivenosťou na thymosin alpha 1 alebo na niektorú zo zložiek injekcie. Vzhľadom na imunomodulačný účinok tymalfasínu je kontraindikovaný aj u pacientov s potlačenou imunitou, ako sú príjemcovia transplantovaných orgánov, pokiaľ prínos liečby neprekročí riziká[35].
Referencie
- Camerini R, Garaci E. Historical review of thymosin α 1 in infectious diseases. Expert Opin Biol Ther. 2015;15 Suppl 1:S117–S127. [PubMed] [Google Scholar]
- Matteucci C, Grelli S, Balestrieri E, Minutolo A, Argaw-Denboba A, Macchi B, Sinibaldi-Vallebona P, Perno CF, Mastino A, Garaci E. Thymosin alpha 1 and HIV-1: recent advances and future perspectives. Future Microbiol. 2017;12:141–155. [PubMed] [Google Scholar]
- Carraro G, Naso A, Montomoli E, Gasparini R, Camerini R, Panatto D, Tineo MC, De Giorgi L, Piccirella S, Khadang B, Ceracchi M, De Rosa A. Thymosin-alpha 1 (Zadaxin) enhances the immunogenicity of an adjuvated pandemic H1N1v influenza vaccine (Focetria) in hemodialyzed patients: a pilot study. Vaccine. 2012;30:1170–1180. [PubMed] [Google Scholar]
- Pica F, Gaziano R, Casalinuovo IA, Moroni G, Buè C, Limongi D, D’Agostini C, Tomino C, Perricone R, Palamara AT, Sinibaldi Vallebona P, Garaci E. Serum thymosin alpha 1 Levels in normal and pathological conditions. Expert Opin Biol Ther. 2018;18:13–21. [PubMed] [Google Scholar]
- Zadaxin (Thymalfasin): Uses, Dosage, Side Effects, Interactions, Warning [Internet]. RxList. 2009. [cited 2020 September 27]. Available from: https://www.rxlist.com/zadaxin-drug.htm#description .
- Li J, Liu CH, Wang FS. Thymosin alpha 1: biological activities, applications and genetic engineering production. Peptides. 2010;31:2151–2158. [PMC free article] [PubMed] [Google Scholar]
- Antachopoulos C, Katragkou A, Roilides E. Immunotherapy against invasive mold infections. Immunotherapy. 2012;4:107–120. [PubMed] [Google Scholar]
- Li C, Bo L, Liu Q, Jin F. Thymosin alpha1 based immunomodulatory therapy for sepsis: a systematic review and meta-analysis. Int J Infect Dis. 2015;33:90–96. [PubMed] [Google Scholar]
- Romani L, Tomino C, Puccetti P, Garaci E. Off-label therapy targeting pathogenic inflammation in COVID-19. Cell Death Discov. 2020;6:49. [PMC free article] [PubMed] [Google Scholar]
- Hoch K, Volk DE. Structures of Thymosin Proteins. Vitam Horm. Epub 2016; 102: 1-24. [PubMed] [Google Scholar]
- Elizondo-Riojas MA, Chamow SM, Tuthill CW, Gorenstein DG, Volk DE. NMR structure of human thymosin alpha-1. Biochem Biophys Res Commun. 2011;416:356–361. [PMC free article] [PubMed] [Google Scholar]
- Thymalfasin [Internet]. Pubchem.ncbi.nlm.nih.gov. [cited 2020 September 27]. Available from: https://pubchem.ncbi.nlm.nih.gov/compound/Thymalfasin .
- King R, Tuthill C. Immune Modulation with Thymosin Alpha 1 Treatment. Vitam Horm. 2016;102:151–178. [PubMed] [Google Scholar]
- Liu XH, Lu SH, Chen J, Xia L, Yang ZG, Charles S, Yang Y, Lin Y, Lu HZ. Clinical characteristics of foreign-imported COVID-19 cases in Shanghai, China. Emerg Microbes Infect. 2020;9:1230–1232. [PMC free article] [PubMed] [Google Scholar]
- Poo JL, Sánchez-Avila F, Kershenobich D, García-Samper X, Gongora J, Uribe M. Triple combination of thymalfasin, peginterferon alfa-2a and ribavirin in patients with chronic hepatitis C who have failed prior interferon and ribavirin treatment: 24-week interim results of a pilot study. J Gastroenterol Hepatol. 2004;19 Suppl 6:S79–S81. [PubMed] [Google Scholar]
- Chen F, Chen XM, Chen Z, Jiang HL, Pan XP, Hu ZR, Liu RH, Chen XM. Construction and application of a yeast expression system for thymosin alpha1. Biocell. 2005;29:253–259. [PubMed] [Google Scholar]
- Chen Y, Wang A, Zhao L, Shen G, Cui L, Tang K. Expression of thymosin alpha1 concatemer in transgenic tomato (Solanum lycopersicum) fruits. Biotechnol Appl Biochem. 2009;52:303–312. [PubMed] [Google Scholar]
- Tuthill CW, Rudolph A, Li Y, Tan B, Fitzgerald TJ, Beck SR, Li YX. Quantitative analysis of thymosin alpha1 in human serum by LC-MS/MS. AAPS PharmSciTech. 2000;1:E11. [PMC free article] [PubMed] [Google Scholar]
- Thymosin alpha 1 steroid [Internet]. Mybiosource.com. [cited 2020 September 27]. Available from: https://www.mybiosource.com/steroid/thymosin-alpha-1/639043 .
- Romani L, Bistoni F, Gaziano R, Bozza S, Montagnoli C, Perruccio K, Pitzurra L, Bellocchio S, Velardi A, Rasi G, Di Francesco P, Garaci E. Thymosin alpha 1 activates dendritic cells for antifungal Th1 resistance through toll-like receptor signaling. Blood. 2004;103:4232–4239. [PubMed] [Google Scholar]
- Romani L, Bistoni F, Montagnoli C, Gaziano R, Bozza S, Bonifazi P, Zelante T, Moretti S, Rasi G, Garaci E, Puccetti P. Thymosin alpha1: an endogenous regulator of inflammation, immunity, and tolerance. Ann N Y Acad Sci. 2007;1112:326–338. [PubMed] [Google Scholar]
- Wu J, Zhou L, Liu J, Ma G, Kou Q, He Z, Chen J, Ou-Yang B, Chen M, Li Y, Wu X, Gu B, Chen L, Zou Z, Qiang X, Chen Y, Lin A, Zhang G, Guan X. The efficacy of thymosin alpha 1 for severe sepsis (ETASS): a multicenter, single-blind, randomized and controlled trial. Crit Care. 2013;17:R8. [PMC free article] [PubMed] [Google Scholar]
- Tuthill C, Rios I, De Rosa A, Camerini R. Thymosin α1 continues to show promise as an enhancer for vaccine response. Ann N Y Acad Sci. 2012;1270:21–27. [PubMed] [Google Scholar]
- Naylor PH, Quadrini K, Garaci E, Rasi G, Hadden JW. Immunopharmacology of thymosin alpha1 and cytokine synergy. Ann N Y Acad Sci. 2007;1112:235–244. [PubMed] [Google Scholar]
- Moody TW. Thymosin alpha1 as a chemopreventive agent in lung and breast cancer. Ann N Y Acad Sci. 2007;1112:297–304. [PubMed] [Google Scholar]
- Armutcu F, Coskun O, Gürel A, Kanter M, Can M, Ucar F, Unalacak M. Thymosin alpha 1 attenuates lipid peroxidation and improves fructose-induced steatohepatitis in rats. Clin Biochem. 2005;38:540–547. [PubMed] [Google Scholar]
- Tuthill C, Rios I, McBeath R. Thymosin alpha 1: past clinical experience and future promise. Ann N Y Acad Sci. 2010;1194:130–135. [PubMed] [Google Scholar]
- Chien RN, Liaw YF, Chen TC, Yeh CT, Sheen IS. Efficacy of thymosin alpha1 in patients with chronic hepatitis B: a randomized, controlled trial. Hepatology. 1998;27:1383–1387. [PubMed] [Google Scholar]
- Sherman KE. Thymosin alpha 1 for treatment of hepatitis C virus: promise and proof. Ann N Y Acad Sci. 2010;1194:136–140. [PubMed] [Google Scholar]
- Eckert K, Schmitt M, Garbin F, Wahn U, Maurer HR. Thymosin alpha 1 effects, in vitro, on lymphokine-activated killer cells from patients with primary immunodeficiencies: preliminary results. Int J Immunopharmacol. 1994;16:1019–1025. [PubMed] [Google Scholar]
- Panatto D, Amicizia D, Lai PL, Camerini R, De Rosa A, Gasparini R. Utility of thymosin alpha-1 (Zadaxin) as a co-adjuvant in influenza vaccines: a review. J Prev Med Hyg. 2011;52:111–115. [PubMed] [Google Scholar]
- Qin Y, Chen FD, Zhou L, Gong XG, Han QF. Proliferative and anti-proliferative effects of thymosin alpha1 on cells are associated with manipulation of cellular ROS levels. Chem Biol Interact. 2009;180:383–388. [PubMed] [Google Scholar]
- Costantini C, Bellet MM, Pariano M, Renga G, Stincardini C, Goldstein AL, Garaci E, Romani L. A Reappraisal of Thymosin Alpha1 in Cancer Therapy. Front Oncol. 2019;9:873. [PMC free article] [PubMed] [Google Scholar]
- Ancell CD, Phipps J, Young L. Thymosin alpha-1. Am J Health Syst Pharm. 2001;58:879–85; quiz 886. [PubMed] [Google Scholar]
- Rekdal M, Pai A, Bs M. Experimental data of co-crystals of Etravirine and L-tartaric acid. Data Brief. 2018;16:135–140. [PMC free article] [PubMed] [Google Scholar]
- Guo Y, Chang H, Li J, Xu XY, Shen L, Yu ZB, Liu WC. Thymosin alpha 1 suppresses proliferation and induces apoptosis in breast cancer cells through PTEN-mediated inhibition of PI3K/Akt/mTOR signaling pathway. Apoptosis. 2015;20:1109–1121. [PubMed] [Google Scholar]
- Sugahara S, Ichida T, Yamagiwa S, Ishikawa T, Uehara K, Yoshida Y, Yang XH, Nomoto M, Watanabe H, Abo T, Asakura H. Thymosin-alpha1 increases intrahepatic NKT cells and CTLs in patients with chronic hepatitis B. Hepatol Res. 2002;24:346–354. [PubMed] [Google Scholar]
- Renault L. Intrinsic, Functional, and Structural Properties of β-Thymosins and β-Thymosin/WH2 Domains in the Regulation and Coordination of Actin Self-Assembly Dynamics and Cytoskeleton Remodeling. Vitam Horm. 2016;102:25–54. [PubMed] [Google Scholar]
- Kim J, Jung Y. Thymosin Beta 4 Is a Potential Regulator of Hepatic Stellate Cells. Vitam Horm. 2016;102:121–149. [PubMed] [Google Scholar]
- Xue B, Robinson RC. Actin-Induced Structure in the Beta-Thymosin Family of Intrinsically Disordered Proteins. Vitam Horm. 2016;102:55–71. [PubMed] [Google Scholar]
- Hsia J, Sztein MB, Naylor PH, Simon GL, Goldstein AL, Hayden FG. Modulation of thymosin alpha 1 and thymosin beta 4 Levels and peripheral blood mononuclear cell subsets during experimental rhinovirus colds. Lymphokine Res. 1989;8:383–391. [PubMed] [Google Scholar]
- Yu K, He J, Wu Y, Xie B, Liu X, Wei B, Zhou H, Lin B, Zuo Z, Wen W, Xu W, Zou B, Wei L, Huang X, Zhou P. Dysregulated adaptive immune response contributes to severe COVID-19. Cell Res. 2020;30:814–816. [PMC free article] [PubMed] [Google Scholar]
- Bergstrom DJ, Kotb R, Louzada ML, Sutherland HJ, Tavoularis S, Venner CP Myeloma Canada Research Network Consensus Guideline Consortium. Consensus Guidelines on the Diagnosis of Multiple Myeloma and Related Disorders: Recommendations of the Myeloma Canada Research Network Consensus Guideline Consortium. Clin Lymphoma Myeloma Leuk. 2020;20:e352–e367. [PubMed] [Google Scholar]
- Zhang L, Liu Y. Potential interventions for novel coronavirus in China: A systematic review. J Med Virol. 2020;92:479–490. [PMC free article] [PubMed] [Google Scholar]
Wegrowski, Y.; Maquart, F.X.; Borel, J.P. (1992). „Stimulation of sulfated glycosaminoglycan synthesis by the tripeptide-copper complex Glycyl-L-histidyl-L-lysine-Cu2+“. Life Sciences. 51 (13): 1049-1056. doi:10.1016/0024-3205(92)90504-i. PMID 1522753.
Maquart, FX; Bellon, G; Pasco, S; Monboisse, JC (2005). „Matrikines in the regulation of extracellular matrix degradation“. Biochimie. 87 (3–4): 353-60. doi:10.1016/j.biochi.2004.10.006. PMID 15781322.
Siméon, A; Wegrowski, Y; Bontemps, Y; Maquart, FX (2000). „Expression of glycosaminoglycans and small proteoglycans in wounds: modulation by the tripeptide-copper complex glycyl-L-histidyl-L-lysine-Cu(2+)“. The Journal of Investigative Dermatology. 115 (6): 962-8. doi:10.1046/j.1523-1747.2000.00166.x. PMID 11121126.
Siméon, Alain; Emonard, Hervé; Hornebeck, William; Maquart, François-Xavier (2000). „The tripeptide-copper complex glycyl-L-histidyl-L- lysine-Cu2+ stimulates matrix metalloproteinase-2 expression by fibroblast cultures“. Life Sciences. 67 (18): 2257-2265. doi:10.1016/s0024-3205(00)00803-1. PMID 11045606.
Gul, NY; Topal, A; Cangul, IT; Yanik, K (2008). „The effects of topical tripeptide copper complex and helium-neon laser on wound healing in rabbits“. Veterinary Dermatology. 19 (1): 7-14. doi:10.1111/j.1365-3164.2007.00647.x. PMID 18177285.
Cangul, IT; Gul, NY; Topal, A; Yilmaz, R (2006). „Evaluation of the effects of topical tripeptide-copper complex and zinc oxide on open-wound healing in rabbits“. Veterinary Dermatology. 17 (6): 417-23. doi:10.1111/j.1365-3164.2006.00551.x. PMID 17083573.
Pickart L. Compositions for accelerating wound healing in mammals containing cupric salt or complexes with amino acid or peptide. US Patent 5,164,367, 1992.
Canapp SO Jr, Farese JP, Schultz GS, Gowda S, Ishak AM, Swaim SF, Vangilder J, Lee-Ambrose L, Martin FG (Nov–Dec 2003). „The effect of topical tripeptide-copper complex on healing of ischemic open wounds“. Veterinary Surgery. 32 (6): 515-23. doi:10.1111/j.1532-950x.2003.00515.x. PMID 14648529.
Kartha, R; Jayakumar, R (2007). „A therapeutic approach for diabetic wound healing using biotinylated GHK incorporated collagen matrices“. Life Sciences. 80 (4): 275-84. doi:10.1016/j.lfs.2006.09.018. PMID 17049946.
Mulder DPM1, Gerit D.; Patt PhD2, Leonard M.; Sanders DPM, Lee; a kol. (1994). „Enhanced healing of ulcers in patients with diabetes by topical treatment of glycyl-l-histidyl-l-lysine“. Wound Repair and Regeneration. 2 (4): 259-269. doi:10.1046/j.1524-475X.1994.20406.x. PMID 17147644. S2CID 24405625.
Bishop, JB; Phillips, LG; Mustoe, TA; VanderZee, AJ; Wiersema, L; Roach, DE; Heggers, JP; Hill Jr, DP; Taylor, EL; Robson, MC (Aug 1992). „A prospective randomized evaluator-blinded trial of two potential wound healing agents for the treatment of venous stasis ulcers“. Journal of Vascular Surgery. 16 (2): 251-257. doi:10.1016/0741-5214(92)90115-o. PMID 1495150.
Gruchlik, A.; Jurzak, M.; Chodurek, E.; Dzierzewicz, Z. (2012). „Effect of Gly-Gly-His, Gly-His-Lys and their copper complexes on TNF-alpha-dependent IL-6 secretion in normal human dermal fibroblasts“. Acta Poloniae Pharmaceutica. 69 (6): 1303-6. PMID 23285694.
Pollard, JD; Quan, S; Kang, T; Koch, RJ (2005). „Effects of copper tripeptide on the growth and expression of growth factors by normal and irradiated fibroblasts“. Archives of Facial Plastic Surgery. 7 (1): 27-31. doi:10.1001/archfaci.7.1.27. PMID 15655171.
Ahmed, M.R.; Basha, S.H.; Gopinath, D.; Muthusamy, R.; Jayakumar, R. (2005). „Initial upregulation of growth factors and inflammatory mediators during nerve regeneration in the presence of cell adhesive peptide-incorporated collagen tubes“. Journal of the Peripheral Nervous System. 10 (1): 17-30. doi:10.1111/j.1085-9489.2005.10105.x. PMID 15703015. S2CID 45020157.
Kang, YA; Choi, HR; Na, JI; Huh, CH; Kim, MJ; Youn, SW; Kim, KH; Park, KC (Apr 2009). „Copper-GHK increases integrin expression and p63 positivity by keratinocytes“. Archives of Dermatological Research. 301 (4): 301-6. doi:10.1007/s00403-009-0942-x. PMID 19319546. S2CID 206973024.
Choi, H.R.; Kang, Y.A.; Ryoo, S.J.; Shin, J.W.; Na, J.I.; Huh, C.H.; Park, K.C. (Nov 2012). „Stem cell recovering effect of copper-free GHK in skin“. Journal of Peptide Science. 18 (11): 685-90. doi:10.1002/psc.2455. PMID 23019153. S2CID 206420349.
Hong, Y; Downey, T; Eu, KW; Koh, PK; Cheah, PY (2010). „A ‚metastasis-prone‘ signature for early-stage mismatch-repair proficient sporadic colorectal cancer patients and its implications for possible therapeutics“. Clinical & Experimental Metastasis. 27 (2): 83-90. doi:10.1007/s10585-010-9305-4. PMID 20143136. S2CID 26719152.
Lamb, J (2007). „The Connectivity Map: a new tool for biomedical research“. Nature Reviews Cancer. 7 (1): 54-60. doi:10.1038/nrc2044. PMID 17186018. S2CID 2930402.
Iorio, F.; Bosotti, R.; Scacheri, E.; a kol. (2010). „Discovery of drug mode of action and drug repositioning from transcriptional responses“. Proceedings of the National Academy of Sciences. 107 (33): 14621-14626. Bibcode:2010PNAS..10714621I. doi:10.1073/pnas.1000138107. PMC 2930479. PMID 20679242.
Campbell, J.D.; McDonough, J.E.; Zeskind, J.E.; Hackett, T.L.; Pechkovsky, D.V.; Brandsma, C.A.; Suzuki, M.; Gosselink, J.V.; Liu, G.; Alekseyev, Y.O.; Xiao, J.; Zhang, X.; Hayashi, S.; Cooper, J.D.; Timens, W.; Postma, D.S.; Knight, D.A.; Marc, L.E.; James, H.C.; Avrum, S. (2012). „A gene expression signature of emphysema-related lung destruction and its reversal by the tripeptide GHK“. Genome Medicine. 4 (8): 67. doi:10.1186/gm367. PMC 4064320. PMID 22937864.
Gorouhi, F.; Maibach, H.I. (2009). „Role of topical peptides in preventing and treating aged skin“. International Journal of Cosmetic Science. 31 (5): 327-345. doi:10.1111/j.1468-2494.2009.00490.x. PMID 19570099. S2CID 205584531.
Abdulghani, AA; Sherr, S; Shirin, S; Solodkina, G; Tapia, EM; Gottlieb, AB (1998). „Effects of topical creams containing vitamin C, a copper-binding peptide cream and melatonin compared with tretinoin on the ultrastructure of normal skin – A pilot clinical, histologic, and ultrastructural study“. Disease Management and Clinical Outcomes. 1: 136–141. doi:10.1016/S1088-3371(98)00011-4.
Finkley MB, Appa Y, Bhandarkar S. Copper Peptide and Skin. Cosmeceuticals and Active Cosmetic, 2nd Edition, P. Eisner and H.I. Maibach (Eds.) Marcel Dekker, New York. 2005:549-563
Uno, Hideo; Kurata, Sotaro (1993). „Chemical Agents and Peptides Affect Hair Growth“. Journal of Investigative Dermatology. 101 (1. dodatok): 143S–147S. doi:10.1111/1523-1747.ep12363275. PMID 8326148.
Perez-Meza, D; Leavitt, M; Trachy, R (1988). „Clinical evaluation of GraftCyte moist dressings on hair graft viability and quality of healing“. International Journal of Cosmetic Surgery. 6: 80-84.
Pickart-Margolina (2018). „Regenerative and Protective Actions of the GHK-Cu Peptide in the Light of the New Gene Data“. International Journal of Molecular Sciences. 19 (7): 7. doi:10.3390/ijms19071987. PMC 6073405. PMID 29986520.
AcneScar.org (2020). „Treat Acne Scars: How to Remove Acne Scars at the Root“.
Conato, Chiara; Gavioli, Riccardo; Guerrini, Remo; Kozłowski, Henryk; Młynarz, Piotr; Pasti, Claudia; Pulidori, Fernando; Remelli, Maurizio (2001). „Copper complexes of glycyl-histidyl-lysine and two of its synthetic analogues: Chemical behaviour and biological activity“. Biochimica et Biophysica Acta (BBA) – General Subjects. 1526 (2): 199-210. doi:10.1016/s0304-4165(01)00127-1. PMID 11325542.
Hureau, C.; Eury, H.; Guillot, R.; Bijani, C.; Sayen, S.; Solari, P.L.; Guillon, E.; Faller, P.; Dorlet, P (2011). „X-ray and solution structures of Cu(II) GHK and Cu(II) DAHK complexes: influence on their redox properties“. Chemistry: A European Journal. 17 (36): 10151-60. doi:10.1002/chem.201100751. PMID 21780203.
Lau, S.J.; Sarkar, B. (1981). „The interaction of copper(II) and glycyl-L-histidyl-L-lysine, a growth-modulating tripeptide from plasma“. Biochemical Journal. 199 (3): 649-56. doi:10.1042/bj1990649. PMC 1163421. PMID 7340824.
Pickart L. The human tripeptide GHK (Glycyl-L-histidyl-L-Lysine), the copper switch and the treatment of the degenerative conditions of aging. Publikácia Anti-Aging Therapeutics Zväzok XI, 301-3012. Vyd. Klatz R. and Goldman R. Chicago, IL, USA: American Academy of Medicine, 2009